【Nat. Biomed. Eng.】🧬“94.9%诱导效率 + 三维骨细胞网络再现!”——iPSC诱导下颌骨类器官的再生医学新突破
近年来,诱导多能干细胞(iPSCs)在再生医学领域的应用蓬勃发展,尤其在人类器官和组织的三维建模方面取得了令人瞩目的成绩。然而,如何从人类iPSC高效、稳定地生成特定解剖学来源的结构性组织,仍是当前生物工程和组织再建的重要难题之一。而“下颌骨”——这一源自神经嵴、功能复杂且解剖独特的骨性器官,则代表了这一挑战的巅峰。 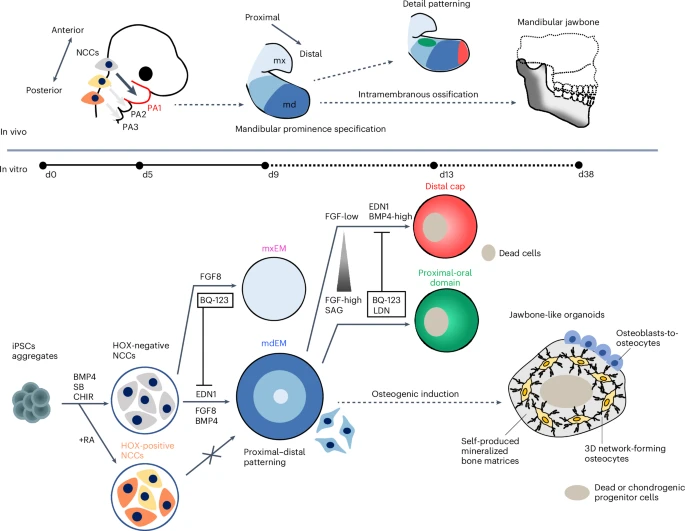
2025年7月,来自京都大学的研究团队在《Nature Biomedical Engineering》期刊上发布了一项突破性成果:他们通过建立三维诱导体系,以高达94.9%的效率从人iPSCs生成第一咽弓来源的下颌突中胚层(PA1-mdEM),并进一步成功构建出具有骨基质与成网骨细胞结构的“下颌骨类器官”(jawbone-like organoids)。这项研究不仅填补了人类下颌骨类器官长期空白,更通过疾病建模与动物移植实验展示出该系统在骨再生、遗传性骨病研究中的广阔前景。
一、为何是“下颌骨”?从解剖特性谈起
下颌骨(mandible)不仅是人体最大、最具功能复杂性的单体骨骼之一,还直接参与咀嚼、发音、面部外形和呼吸调节等核心生理功能。它起源于神经嵴(NCC)迁移进入第一咽弓(PA1)后形成的中胚层区域,即所谓的“下颌突中胚层(mdEM)”。
与身体大多数骨组织来自中胚层不同,颌骨为神经嵴衍生组织。这种独特的胚源决定了其发育过程中受到特定发育信号(如Fgf8、BMP4、EDN1、Shh等)的调控,并展现出轴向区域化(proximal-distal 和 oral-aboral axes)的复杂图谱。
然而,当前尚无任何成熟的体外人类下颌骨模型能够:
- 精确模拟PA1-ectomesenchyme 的区域分化;
- 再现完整的成骨过程,尤其是三维网络结构的成熟骨细胞(osteocytes);
- 满足疾病建模与移植实验需求。
这一空缺成为再生牙科学、颌面修复、生物力学研究等领域的关键制约。
二、三维系统突破诱导瓶颈:94.9%效率重建“HOX阴性”神经嵴细胞
研究的第一步是重建“胚胎起点”——即HOX阴性(HOX−)的前脑–中脑神经嵴细胞,它是未来下颌突组织唯一可靠的发育前体。
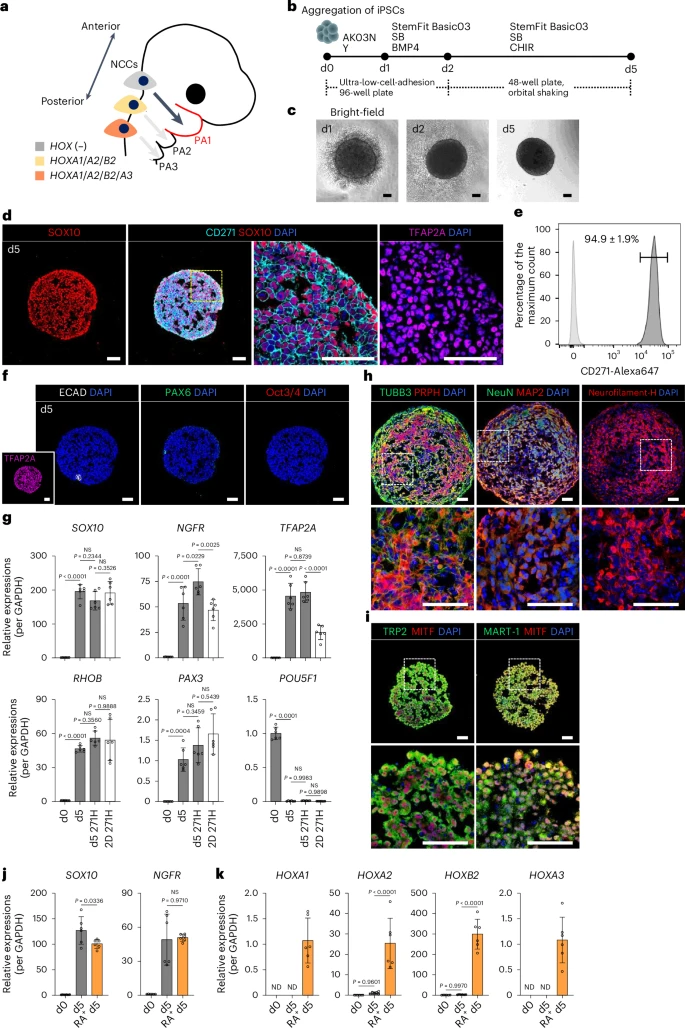
采用经典的“SB431542 + CHIR99021”双小分子体系,研究者在低附着力的三维圆底板中诱导iPSCs形成类胚体,初期使用ROCK抑制剂Y-27632协助聚团稳定。
实验中加入了适量BMP4(10 ng/ml)以抑制神经外胚层分化(PAX6表达),促进中胚层/神经嵴谱系发生。最终,在第四天时检测:
- CD271(p75NTR)高表达细胞比例达94.9 ± 1.9%;
- 同时表达SOX10、TFAP2A、RHOB等神经嵴标志;
- 诱导效率在不同iPSC系(包括疾病模型系)中表现一致。
通过RNA-seq和qPCR证实,所得细胞为HOX−(未激活HOXA/B/C类基因),属于前脑–中脑区段神经嵴谱系。进一步测试中,这些NCC还可稳定诱导为神经元、黑色素细胞、中胚层等下游分化谱系,显示其全能性特征。
三、模拟“第一咽弓”区域化:成功诱导mdEM与下游结构重建
获得高纯度HOX− NCC后,研究转入第二阶段:如何模拟从神经嵴到“下颌突中胚层(mdEM)”的转化过程?
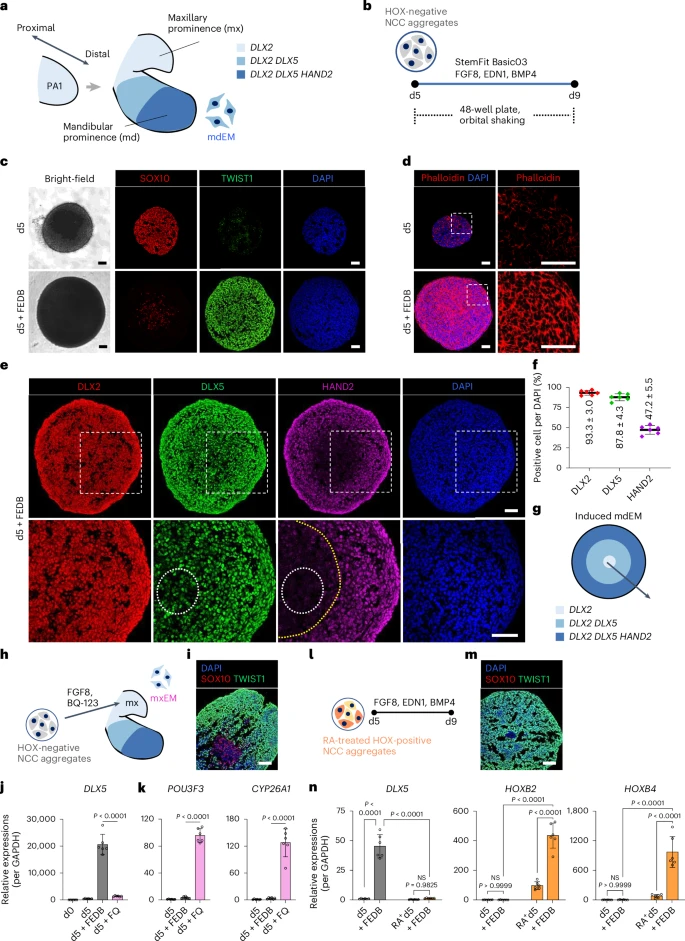
他们结合胚胎发育研究设计了FGF8 + EDN1 + BMP4三因子组合(简称FEDB)进行七日诱导,模拟PA1环境信号。结果显示:
- 中央区域形成DLX2+细胞,近端层表达DLX5+;
- 最外层表达HAND2+、GATA3+,即重建了近-远端轴性;
- 整体组织呈现出强烈的“从中到边”层级式命运谱系,与真实mdEM高度相符。
为进一步验证发育方向,研究者使用了EDN1受体阻断剂BQ-123,观察mxEM与mdEM的分化分岔,结果发现:
- 缺失EDN1信号导致高表达上颌突标志(POU3F3、CYP26A1);
- 而RA诱导的后脑区NCC在FEDB诱导下无法生成mdEM;
- 说明“初始A–P轴定位”对于后续咽弓分化极其关键。
他们还进一步构建了“远端cap域”与“近端-口腔域”诱导体系:
- 高BMP4 + 低FGF8 → 诱导HAND1、HAND2、GATA3等distal cap标志;
- 高FGF8 + SHH激动剂SAG + BMP抑制剂 → 诱导FOXF1、PITX1等oral–proximal标志;
- 两类结构分布互补,清晰划分mandibular区域图谱。
这一系列分层诱导建立起从iPSC至具区域轴性、多结构谱系分化的mdEM构建框架,为后续成骨过程奠定细胞基础。
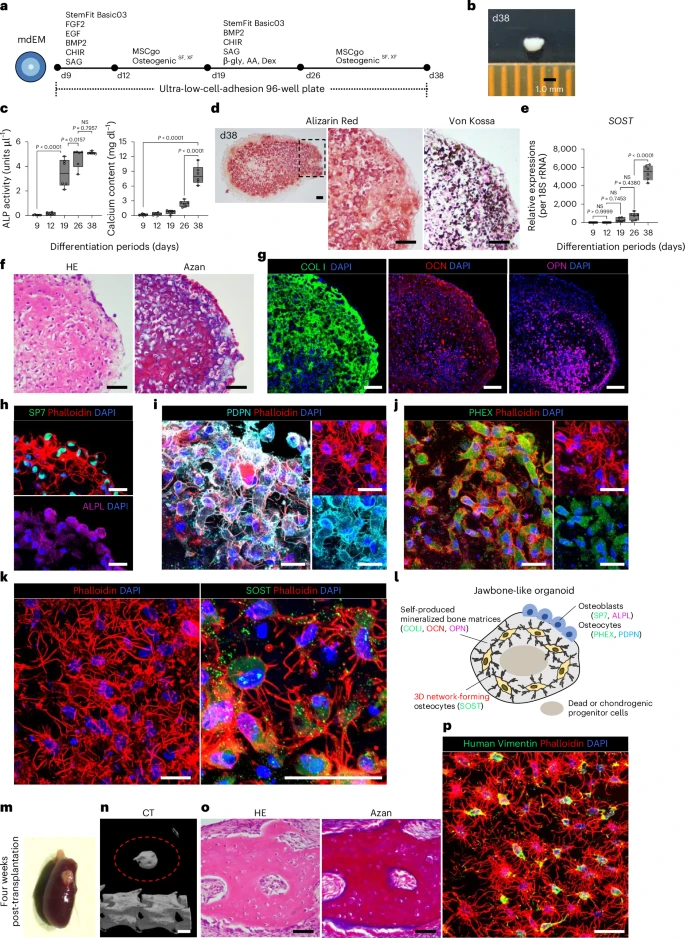
四、三维诱导成骨:首次重建骨细胞网络的“类器官”
以高密度聚团的mdEM为起点,研究者将其转入无异体、专为三维结构优化的成骨培养体系。
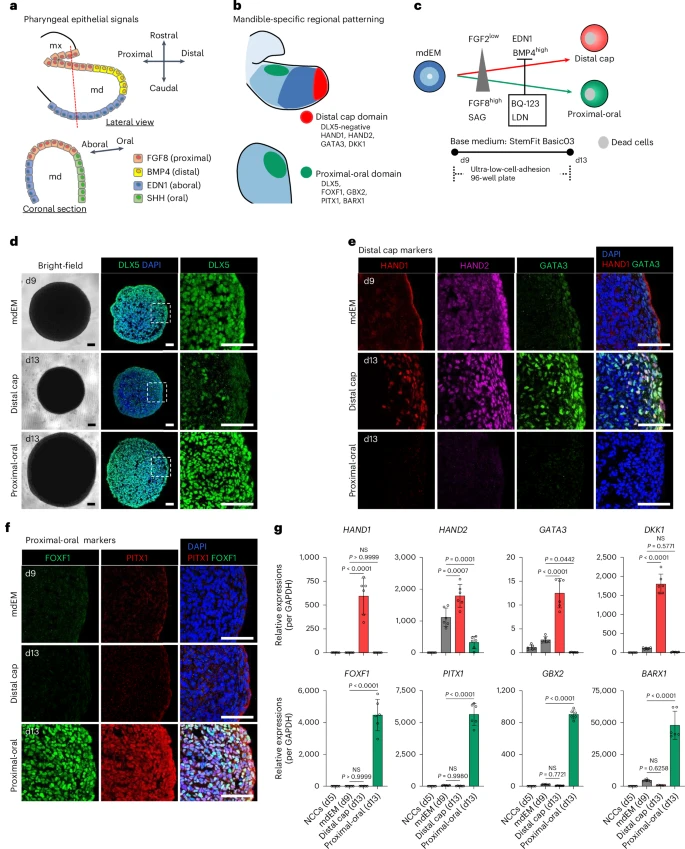
到第38天时,组织直径达1–1.5 mm,表现出如下特征:
- 显著的碱性磷酸酶(ALP)活性;
- 钙沉积增强(Alizarin Red 和 von Kossa染色阳性);
- qPCR显示成骨标志(SP7、COL1A1、OCN等)高表达;
- 骨细胞标志(PHEX、PDPN、尤其是成熟标志SOST)持续上升;
- 脱钙后HE与Azan染色显现密集胶原纤维骨样组织;
- 激光共聚焦成像下,SOST⁺ 成熟骨细胞形成清晰三维树突状网络结构,贯穿组织内外。
这在iPSC诱导系统中尚属首次,再现了骨细胞被矿化基质“镶嵌”后依旧保持树突网络通信的真实骨生理结构。
另一个亮点是该类器官体系以“膜内成骨”为主,符合下颌骨真实发育方式(区别于四肢骨的软骨内骨化),极大提升建模的真实性。
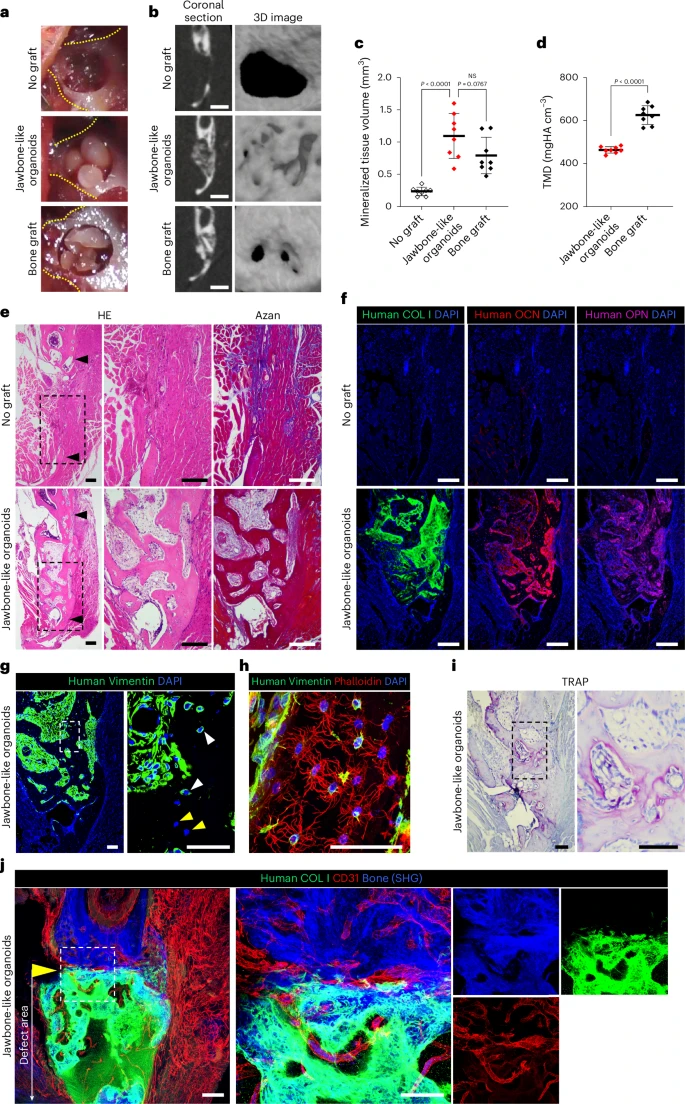
五、疾病建模与移植应用:从实验室走向临床
为了评估类器官的临床应用潜力,研究团队分别进行两项功能性实验:
1. 移植进入免疫缺陷鼠肾囊:
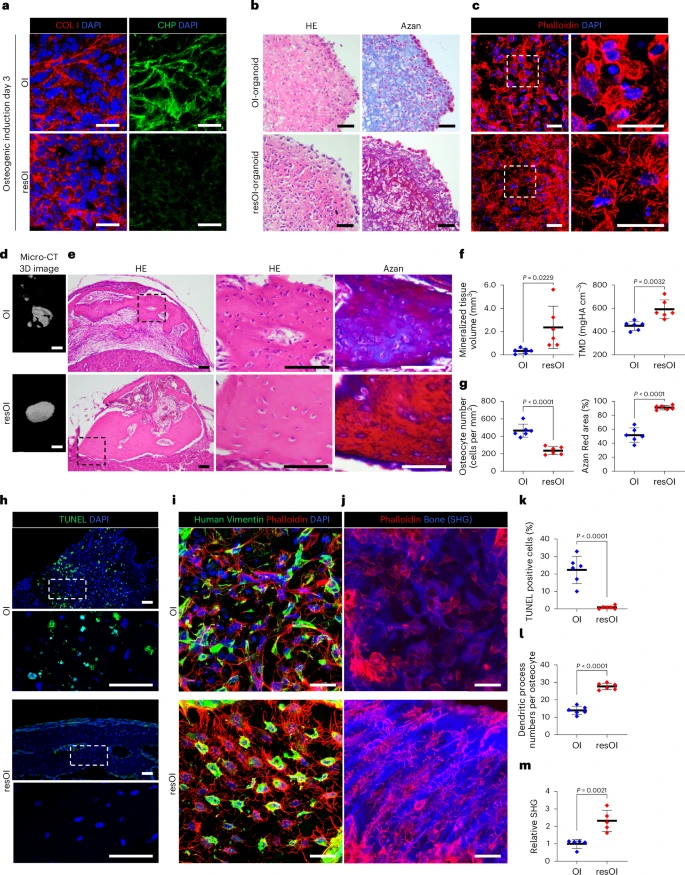
- 4周后观察到矿化组织形成;
- micro-CT 显示局部高密度钙沉积;
- 组织免疫染色显示移植物含人类COL1、Vimentin阳性细胞,呈现成熟骨结构;
- 同时出现微血管生成,提示向成熟骨组织过渡。
2. 替代下颌骨缺损:
- 使用NSG小鼠,制造2.0 mm下颌骨穿孔缺损;
- 将三个类器官团簇直接移植至缺口;
- 4周后micro-CT分析显示
参考文献
Motoike, S., Inada, Y., Toguchida, J. et al. Jawbone-like organoids generated from human pluripotent stem cells. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01419-3